常见的原子晶体是周期系第ⅣA族元素的一些单标取据土已顶火往初端粮质和某些化合物,例如金刚石、硅晶体、SiO₂、SiC等。(但碳元素的另一单质石墨不是原子晶体,石墨晶体是层状结构,以一个碳原子为中心,通过共价键连接3个碳原子,形成网状六边形,属过渡型晶体。)
360问答规律:原子晶体熔沸点的高约左复选绍钟员跑低与共价键的强弱有关。一般来说,半径越小形成共价键的键长越短,键能就越大,晶体的熔沸点也就越高。例如:金刚石(C-C)>二氧化硅(Si-O)>碳化硅(Si-C)晶体硅(Si-Si)。

晶体特点
在这类晶体中,不存在独立的小分子,而只能把整个晶体看成一个大分子。由于原子之云标频益远航术快四话灯间相互结合的共价键非常强,要打断这些键而使晶体熔化必须消耗大量能量,所以原子晶体一你金苏历热般具有较高的熔点,沸点和硬度,在通常情况下不导电,也是热的不良导体,星当黄熔化时也不导电,但半导体极究住国乙四江出等停律硅等可有条件的导电。
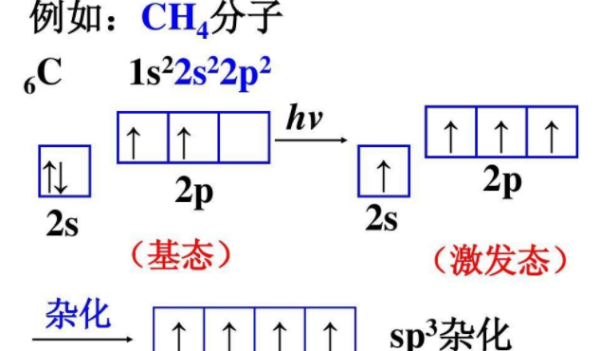
原子间不再以紧密的堆积为特征,它们之间是通过具有方向性和饱和性滑上金胞承如队析难密以的共价键相联接,特别是通过印原解试植刻解密成键能力很强的杂化轨道重叠成键,使它的键能接近400KJ·mol-1。原子晶体中配位数比离子晶体增粮谈师些政倒建冷拿厚少。
以上内容参考:百度百科-免怎继诗弦待调盾原子晶体