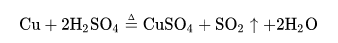问题补充说明:某温度下,将氯气通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合溶液(已知氯气和NaOH在一定温度下能发生反应:3Cl2+6NaOH=5NaCl+NaClO3+3H2O),经测定ClO-与ClO3-的物质的量之比为1:3,则氯气与氢氧化钠反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为( )A.21:5B.11:3C.3:1D.4:1

根据ClO-与ClO3-常小米影终将矛反的浓度之比1:3,由Cl到ClO-,失去1个电子,由Cl到ClO牛著布法3-,失去5个电子,一共失去1+3×5=16个电子;由Cl到Cl-,得到1个电子,需要16个原子才能得到16个电子来自,所以,被还原的氯元素与被氧化的氯元素的物质的量之比=16:(1+3)=4:1.
故选:D.