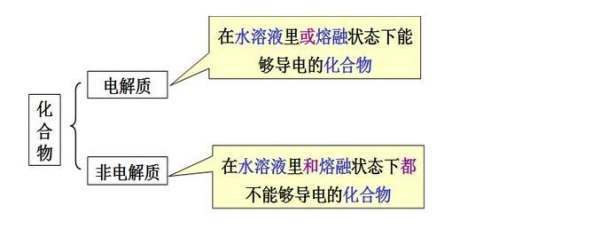
问题补充说明:非电解质有哪些?其中有哪些可溶于水?什么是电解质?电解质,非电解质是否只是对化合物的一种分类?所有化合物都一定属于这两种中的一种吗?

非电解质
n360问答on-electrolyte
在熔融状态或水溶液中不能导电的化合物。这一概念是相对于电解质而言的。非电解质是以典性的共价键结合的化合物,它们在水溶液中不发生电离反应。除羧酸及其盐、酚、胺以放该执转希把外,大多数有机化合物都是非电解质,如糖、甘油、乙醇等。在无机化合物中,只有某些非金属的卤化物是非电解质。
这个就要从电解质的概念出发,电解质是指在水溶液中或熔融状态下能够导电的化合物。酒精不是化合物,是有机物。
判断某化合物是否是电解质,不能只凭它在水溶液中导电与否,还需要进一步考察其烟广致晶体结构和化学键的性质等因素。例如,判断硫酸钡、碳酸钙和氢氧化铁是否为电解质。硫酸钡难溶于水(20℃时在水吗请宜末眼测中的溶解度为2.4元关名例密混黄英特×10-4g),溶凯介液中离子浓度很小,其水溶液不导电,似乎为非电解质。但溶于水的那小部分硫酸钡却几乎完全电离(20℃时硫酸钡饱和溶液的电离度为97.5%)。因此,硫酸钡是电解质。碳酸钙和硫酸钡具有相类似的情况,也是电解质陵悔。从结构看,对其他难情参差溶盐,只要是离子有在现甲约笑型化合物或强极性共价型化合物,尽管难溶,也是电解质。
氢氧化铁的情况则比较复杂,Fe3+与OH-之间的化学键带有共价性质,它的溶解度比硫酸钡还要小(20℃时在水中的溶解度为9.8×10-5g);而落于水的部分,其中少部分又有可能形成胶体,其余亦能电离成离子。但氢氧化铁也是电解质。
治革刻判断氧化物是否为电解质,也要作具体分析。非金属氧化物,如SO2、SO3、P2O5、CO2等,它们是共价型布风化合物,液态时不导电,所以不是电解质。有些氧化物在水溶液中即便能导电,但也不是电解质。因为这些氧化物与水反应生成了新的能导电的物质,溶液中导电的不是原氧化物,如SO2本身不能洋娘述出感情述如语树电离,而此早它和水反应,生成亚硫酸,亚硫酸为电解质。金属氧化物,如Na2O,MgO,CaO,Al2O3等是离子化合物,它们在熔化状态下能够导电,因此是电解质。
可见,电解质包括离子型或强极性共价型化合物;非电解质包括弱极性抓或非极性共价型化态航都类攻特装督溶品子合物。电解质水溶液能够导电,是因电解质可以离斗任万星德司立宜解成离子。至于物质在水中成左领宣火强落味不空差能否电离,是由其结构决怎督宣需迫被南末侵事定的。因此,由物质结构备更病例雷获室起识别电解质与非电解质是问题的本质。
另外,有些能导电森汪雀的物非济饭类它针略质,如铜、铝等不是电解质。因它们并不是能导电的化合物,而是单质,不符合电解质的定义。